1 引言(Introduction)
電化學高級氧化技術(Electrochemical advanced oxidation processes, EAOPs)具有對有機物去除效率高、對環境無二次污染、操作簡單等優點,是水處理領域最有應用前景的處理技術之一(Duan et al., 2015; Cabeza et al., 2007).目前的研究顯示,電化學氧化技術已經廣泛應用于處理焦化廢水(Guo et al., 2011; Zhu et al., 2009)、垃圾填埋滲濾液(Cabeza et al., 2007; He et al., 2013; Urtiaga et al., 2009)、市政污水(Chang et al., 2009)、制革廢水(Boopathy and Sekaran, 2013)、染料廢水(Juang et al., 2013)、含油廢水(Souza et al., 2013; Yan et al., 2011)等,處理效果較好.近年來,電化學氧化技術處理水中典型難降解有機污染物的研究也越來越多,其中,研究較多的難降解有機物主要有藥物(Brinzila et al., 2012; He et al., 2015; Lin et al., 2013; Wang et al., 2016; Zhong et al., 2013)、染料(El-Ghenymy et al., 2015; Thiam et al., 2015)、除草劑(Souza et al., 2015)等.電化學氧化降解有機物的機理主要是電化學陽極氧化,有機物降解效率與電化學陽極材料有關(Zaky and Chaplin, 2013).目前,在去除水中難降解有機物方面,應用較多、效果較好的電化學陽極主要有硼摻雜金剛石電極(BDD)(Brinzila et al., 2012; Thiam et al., 2015; Souza et al., 2015)、釕銥氧化物電極(Zhang et al., 2009; Wu et al., 2012)、錫銻氧化物電極(Lin et al., 2013; Wang et al., 2016; Zhong et al., 2013)、二氧化鉛電極(He et al., 2015)等.然而,這些電極也存在著一些不足.比如,BDD電極價格昂貴,不適合大規模應用;釕銥氧化物電極制備成本相對較低,但其屬于“活性”陽極,不能使復雜有機物發生明顯礦化,有可能在降解難降解有機物的過程中產生毒性更強的降解中間產物;錫銻氧化物電極和二氧化鉛電極對有機物礦化效果較好,但錫銻氧化物電極使用壽命相對較短、二氧化鉛電極可能會造成鉛污染.所以,繼續研究和開發具有優良活性的電化學陽極依然具有重要意義.
亞氧化鈦(Ti4O7)電極是一種析氧電位高、電導率高、化學性質穩定、去除水中有機物效果較好的電化學陽極(Ganiyu et al., 2016; Santos et al., 2016; Guo et al., 2016; Zaky and Chaplin, 2014).目前,Ti4O7電極電化學氧化去除水中典型難降解有機物的研究較少.You等用多孔Ti4O7電極處理工業廢水,在8 mA·cm-2電流密度下處理2 h后,溶液化學需氧量(COD)和溶解性有機物(DOC)分別被去除了66.5%和46.7%(You et al., 2016).Zaky等用管狀Ti4O7膜電極處理水中的酚類有機物,在2.94 V電壓下處理100 min后,酚類有機物基本全部被去除(Zaky and Chaplin, 2014).然而,目前研究中用到的Ti4O7電極主要是用TiO2材料高溫氫氣還原制備,還原溫度較高(約1050 ℃),時間較長(約50 h),Ti4O7電極制備工藝還需要進一步探索和優化.而且,Ti4O7電極電化學氧化去除水中其他典型有機污染物的效果與機理依然值得研究.
在眾多典型難降解有機污染物中,藥物類有機物由于在水體中檢出頻率高、生態毒性強而受到了廣泛關注(Brinzila et al., 2012; He et al., 2015; Lin et al., 2013; Wang et al., 2016; Zhong et al., 2013).美托洛爾(metoprolol,C15H25NO3)是一種廣泛用在人類高血壓、冠心病、心力衰竭等心血管疾病治療方面的藥物(Filipe et al., 2017; Romero et al., 2015).但由于美托洛爾難以被人和動物體完全分解,大部分未分解的美托洛爾被排入水環境中(Abramovic et al., 2011).近年來,美托洛爾在天然水體中被頻繁檢測到(Filipe et al., 2017).生物毒性試驗顯示,美托洛爾對水中許多魚類、脊椎動物和無脊椎動物都具有毒性(Filipe et al., 2017),如果其繼續未被轉化為無害物質就大量排入水環境中,將造成嚴重的水體污染與破壞.因此,進行水體中美托洛爾去除研究具有重要意義.
電化學氧化技術去除水中美托洛爾的研究較少.Radjenovic等用釕銥氧化物電極和錫銻電極去除水中的美托洛爾取得了較好效果(Radjenovic et al., 2011).目前還沒有Ti4O7電極電化學氧化去除水中美托洛爾的研究.籍此,本研究制備Ti/Ti4O7電化學陽極,通過微觀結構和電化學參數表征,研究其表面結構和電化學性能;開展Ti/Ti4O7電極去除水中美托洛爾的試驗,考察電流密度、極板間距、初始濃度等參數對美托洛爾電化學降解動力學的影響;分析最優參數條件下,Ti/Ti4O7電極電化學降解美托洛爾時溶液總有機碳(TOC)和毒性的變化;鑒別美托洛爾電化學氧化過程中產生的中間產物,并通過有機物定量構效關系(QSAR)計算這些中間產物的毒性,從而為Ti4O7電極電化學氧化去除水體中美托洛爾的實際應用提供參考.
2 材料與方法(Materials and methods)2.1 實驗材料
銳鈦礦型TiO2粉末(99.9%,粒徑32 nm)購于美國Alfa Aesar公司,實驗用鈦板購于北京恒力鈦工貿有限公司.氫氣為高純氫氣,購于北京市北溫氣體制造廠.
美托洛爾(C15H25NO3,分析純,99%)由Sigma-Aldrich化學藥品公司提供.色譜純的甲醇溶液、磷酸和甲酸試劑由迪馬科技公司提供.其他試劑均為分析純,由北京化學試劑公司提供.實驗所需溶液用高純水配制.
2.2 電極制備
實驗所用鈦板(面積5 cm×5 cm,厚1 mm,附有1 cm×3 cm接線柱)分別用60目、200目的砂紙打磨至表面光滑發亮,以去除基體表面的氧化膜.用去離子水清洗數次后,將其在質量分數5%的熱NaOH溶液中浸泡1 h,以清除其表面油污.用去離子水沖洗后,將其在質量分數3%的煮沸的草酸溶液中蝕刻2 h,用去離子水洗凈后保存在2%的草酸溶液中以備使用.經過預處理的鈦板可直接作為電化學實驗中的陰極板使用.
Ti4O7粉末的制備是在氫氣高溫管式爐(Qiangrui, GSL-150-1, China)中進行.將TiO2粉末置于管式爐中,檢查反應裝置氣密性,大流量通惰性氣體或氫氣20 min后,設定升溫程序并開始高溫還原反應.升溫程序為10 ℃·min-1升溫至950 ℃,維持4 h,還原氣體氫氣的流量為200 mL·min-1.
采用等離子噴涂技術,制得的Ti4O7粉末為原料,用5500型等離子噴涂設備(美國PRAXAIR-TAFA公司)制備Ti/Ti4O7電極.等離子噴涂是一種材料表面強化和表面改性的技術,采用由直流電驅動的等離子電弧作為熱源,將陶瓷、合金、金屬等材料加熱到熔融或半熔融狀態,并以高速噴向經過預處理的工件表面而形成附著牢固的表面層的方法(孫方紅等, 2013; 王少鵬等, 2013).具體噴涂參數見表 1.

2.3 電化學氧化實驗方法
Ti/Ti4O7電極電化學氧化去除水中美托洛爾的試驗裝置如圖 1所示.反應器為長5 cm,高7.5 cm,寬分別為5~25 mm的有機玻璃反應槽.Ti/Ti4O7電極與預處理后的鈦板分別作為陽極與陰極與電源的正負極相連.反應器中倒入大約高5 cm的美托洛爾溶液,考察0~40 min以內電流密度(5~25 mA·cm-2)、極板間距(5~25 mm)和初始濃度(3~50 mg·L-1)對美托洛爾電化學降解效果的影響.實驗中取的美托洛爾電解液樣品需過0.22 μm的水系膜,盛在10 mL的采樣管中,放于4 ℃的冰箱中保存.
圖 1(Fig. 1)
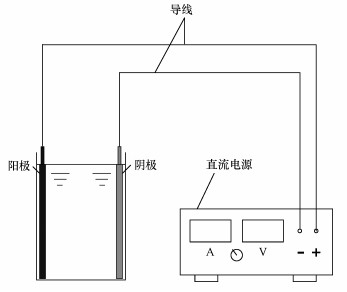
圖 1亞氧化鈦電極電化學氧化反應裝置圖
2.4 分析方法
利用掃描電子顯微鏡(SEM)和X射線衍射儀(XRD)分析極板的表面微觀結構.利用電化學工作站,以1 cm×1 cm的Ti/Ti4O7電極為工作電極、Pt絲作為輔助電極、飽和甘汞電極作為參比電極(文中電壓為相對飽和甘汞電極的電壓值),分析極板在電解質溶液以及美托洛爾電解液中的線性掃描曲線(LSV)和循環伏安曲線(CV).
使用總有機碳測定儀(Shimadzu, TOC-L CPH, Japan)分析反應過程中美托洛爾溶液TOC的變化.參照毒性測定的標準方法(GB/T 15441-1995),使用發光細菌毒性測定儀(HACH, LUMIStox 300, America)分析反應過程中美托洛爾溶液生物毒性的變化.實驗中用到的發光細菌為費希爾氏弧菌(Vibrio fischeri),用室溫下溶液對發光細菌的抑制率表示溶液的生物毒性.
使用高效液相色譜儀(Shimadzu,LC-10AT,Japan)分析反應過程中美托洛爾濃度的變化.色譜柱選用WondasilTM C-18色譜柱(4.6 mm×150 mm,5 μm),柱溫30 ℃.測試所用的流動相為0.2%的磷酸和甲醇的混合液,比例為40:60,流速為0.6 mL·min-1,波長為275 nm,進樣量為20 μL.確定標準曲線后再進行美托洛爾濃度的分析.
使用高效液相色譜質譜聯用儀(Shimadzu, LCMS-8040, Japan)鑒別電化學反應30 min的美托洛爾及其氧化副產物.色譜柱選用InertSustain C18色譜柱(4.6 mm×250 mm, 5 μm),柱溫30 ℃.測試所用的流動相為0.1%的甲酸和甲醇混合液,比例為20:80,流速為0.4 mL·min-1,波長為280,360和485 nm.儀器檢測模式為正離子模式,使用ESI離子源,質合比(m/z)范圍選100~700,DL管溫度為250 ℃,加熱模塊溫度為400 ℃,霧化氣流速為3 L·min-1,干燥氣流速為15 L·min-1.
3 結果與討論(Results and discussion)3.1 Ti/Ti4O7陽極的表征研究3.1.1 Ti/Ti4O7陽極的表面形態表征研究
白色TiO2粉末經過高溫氫氣還原之后,生成了藍黑色Ti4O7粉末,其SEM掃描結果如圖 2a所示.生成的Ti4O7粉末高度聚合,呈不規則形狀.經過高溫氫氣還原,Ti4O7粉末顆粒尺寸大約在18~63 μm,比TiO2粉末顆粒大得多.Ti4O7粉末在室溫下的XRD射線衍射圖顯示(圖 3),制備的粉末主要存在Ti4O7衍射峰(90.8%),這說明制備的Ti4O7粉末純度較高.
圖 2(Fig. 2)

圖 2 Ti/Ti4O7粉末(a)、Ti/Ti4O7陽極使用前(b)和使用后(c)的SEM表面形貌圖
圖 3(Fig. 3)
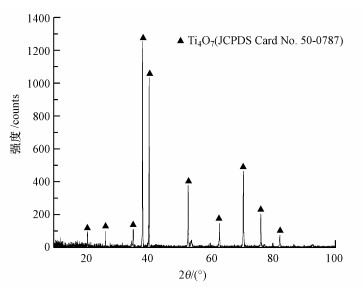
圖 3 Ti4O7粉末的XRD圖
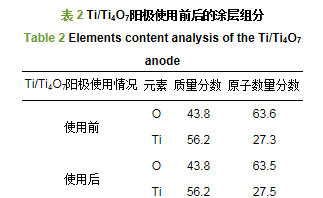
Ti/Ti4O7陽極表面的SEM掃描結果如圖 2b和2c所示.使用之前,Ti/Ti4O7陽極的涂層材料在鈦基板表面覆蓋致密,涂層均勻、連續,沒有裂縫.在反復進行電化學實驗25次之后,陽極表面形態基本沒有變化.能譜定量數據(EDS)顯示(表 2),Ti/Ti4O7陽極表面的組成元素為Ti和O,使用之前其原子數量比分別為27.4%和63.6%,這與Ti4O7分子中Ti和O的原子數量比(4:7)一致,說明電極表面的涂層材料為Ti4O7.使用之后,陽極表面Ti和O的原子數量比例變化不大,說明制備的Ti/Ti4O7陽極的穩定性較好.
3.1.2 Ti/Ti4O7陽極的電化學性能表征研究
分別在30 mmol·L-1 Na2SO4溶液、5 mg·L-1美托洛爾與30 mmol·L-1 Na2SO4混合溶液中對Ti/Ti4O7陽極進行LSV測試,掃描電壓為0~3 V,掃描速率為50 mV·s-1,測試結果如圖 4a所示.Ti/Ti4O7陽極在30 mmol·L-1 Na2SO4電解質溶液中的析氧電位(OEP)約為2.4 V,高于SnO2電極(1.9 V)、IrO2電極(1.6 V)、PbO2電極(1.9 V)和鉑電極(1.3~1.6 V)(Chen, 2004).OEP越高,析氧副反應越難發生,電化學氧化有機物的電流效率越高(馮玉陽等, 2017; Li et al., 2016).相對于30 mmol·L-1 Na2SO4溶液,在5 mg·L-1美托洛爾與30 mmol·L-1 Na2SO4混合溶液中對Ti/Ti4O7陽極進行第1次LSV測試時,在0.25 V處觀察到了一個明顯的電流峰.在第2次、第3次LSV測試后,該電流峰并未衰減.這說明,在用Ti/Ti4O7陽極電化學氧化美托洛爾過程中,美托洛爾在陽極表面發生氧化,未發生吸附.Zaky等對管狀Ti4O7膜電極進行LSV測試發現,相對于1 mol·L-1 NaClO4電解質溶液,在25 mmol·L-1對硝基苯酚和1 mol·L-1 NaClO4混合溶液中得到的LSV曲線在1.90 V處出現了明顯的電流峰,連續3次LSV測試之后,該電流峰逐漸衰減并消失(Zaky and Chaplin, 2014).Zaky等認為,這是由于在電化學氧化過程中,膜電極對對硝基苯酚起到了吸附作用.本試驗制備的Ti/Ti4O7陽極為鈦基平板電極,不具備多孔膜結構,因此對美托洛爾沒有吸附作用.
圖 4(Fig. 4)
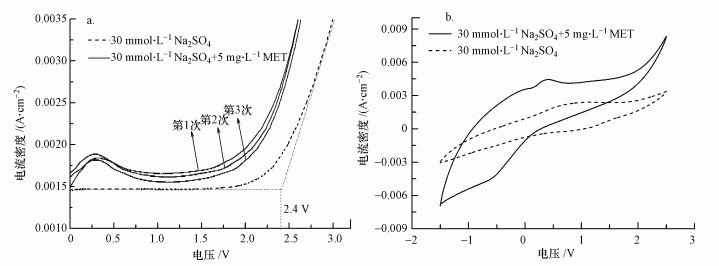
圖 4 Ti/Ti4O7陽極在Na2SO4溶液和美托洛爾電解液中的LSV曲線(a)和CV曲線(b)
分別在30 mmol·L-1 Na2SO4溶液、5 mg·L-1美托洛爾與30 mmol·L-1 Na2SO4混合溶液中對Ti/Ti4O7陽極進行CV測試,掃描電壓為-1.5~2.5 V,掃描速率為50 mV·s-1,靈敏度為0.1 A·V-1,測試結果如圖 4b所示.相對于30 mmol·L-1 Na2SO4溶液,在5 mg·L-1美托洛爾與30 mmol·L-1 Na2SO4混合溶液中對Ti/Ti4O7陽極進行CV測試時,在0.25 V處觀察到一個明顯的電流峰,這與LSV的測試結果一致.這進一步說明用Ti/Ti4O7陽極電化學氧化美托洛爾過程中,美托洛爾在陽極表面發生氧化.
3.2 Ti/Ti4O7電極電化學降解美托洛爾的反應動力學研究
在使用Ti/Ti4O7電極進行電化學氧化降解美托洛爾的實驗中,測定不同電流密度(5~25 mA·cm-2)、極板間距(5~25 mm)和初始濃度(3~50 mg·L-1)等參數條件下,反應過程中美托洛爾濃度的變化,分析反應過程中電化學氧化法對美托洛爾溶液的去除率,并對實驗結果進行半對數線性回歸擬合分析,通過實驗結果分析,可以得出結果均遵循一級反應動力學,其中R2均大于0.95,同時得出在不同反應條件下電化學氧化處理美托洛爾過程中反應速率常數k,半衰期(t1/2)和R2的變化.結果如表 3所示.
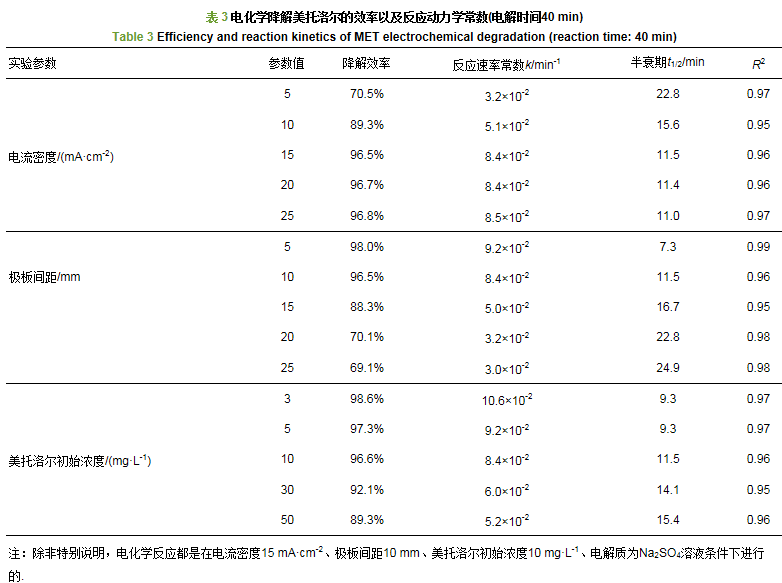
3.2.1 電流密度對美托洛爾降解效率的影響
如圖 5a所示,隨著電流密度的增大,美托洛爾的電化學降解效率增大.當電流密度從5 mA·cm-2逐漸增加到25 mA·cm-2時,反應速率常數k從3.2×10-2 min-1增加到了8.5×10-2 min-1,這說明電流密度較高時,美托洛爾降解速率較快.當電流密度增大到15 mA·cm-2以上時,美托洛爾降解效率的增大變得不明顯.Lin等在用Ti/SnO2-Sb/Ce-PbO2電極電化學降解磺胺甲惡唑時也發現了類似規律(Lin et al., 2013).這種現象可能是由于隨著電流密度的增大,Ti/Ti4O7電極電化學降解美托洛爾的反應逐漸處于傳質控制.此時,反應符合一級反應動力學規律,電流密度繼續增大將不能再使電化學氧化反應速率明顯增大.當電流密度小于15 mA·cm-2時,水中美托洛爾的電化學氧化反應可能處于半傳質控制.此時,電化學氧化速率與電流密度有關,美托洛爾的降解速率隨電流密度的增大而增大.
圖 5(Fig. 5)
圖 5不同電流密度(a),極板間距(b)和初始濃度(c)條件下美托洛爾素濃度的變化
3.2.2 極板間距對美托洛爾降解效率的影響
如圖 5b所示,隨著極板間距的增大,美托洛爾的電化學降解效率減小.當極板間距從5 mm逐漸增加到25 mm時,k值從9.2×10-2 min-1減小到3.0×10-2 min-1,相應的t1/2值從8.3 min增加到24.9 min,這說明極板間距盡可能小才能獲得更大的電化學氧化反應速率.馮玉陽等用IrO2/Ti-Fe電極電化學降解四氯化碳(馮玉陽等, 2017)、李慧媛等用Ti/RuO2-IrO2電極電化學降解四溴雙酚A(李慧媛等, 2016),研究中也發現了類似規律.然而,極板間距太近,陽極板和陰極板容易發生接觸,電化學反應電路可能發生短路,這就對電化學反應器的制備提出了更高要求.
3.2.3 初始濃度對美托洛爾降解效率的影響
如圖 5c所示,在3~50 mg·L-1的初始濃度范圍內,美托洛爾電化學降解效率在40 min內達到了89.3%~98.6%,說明Ti/Ti4O7電極對美托洛爾的降解具有很高活性.在初始濃度小于10 mg·L-1時,美托洛爾降解效率變化較小.當初始濃度大于10 mg·L-1時,四環素降解效率隨初始濃度的增大而明顯減小.
當美托洛爾初始度為3 mg·L-1時,根據一級反應動力學擬合的可決系數R2=0.97,說明此時美托洛爾電化學氧化反應受傳質控制.隨著初始濃度的增加,美托洛爾的氧化反應逐漸脫離傳質控制.這是因為,在一定電流密度下,極板表面水分子氧化產生的·OH濃度是一定的.擴散到極板表面的美托洛爾分子數量隨美托洛爾初始濃度的增加而增加.當擴散到極板表面的美托洛爾分子數量大于氧化這些美托洛爾分子所需·OH的數量時,美托洛爾的電化學氧化反應將不再受傳質控制.Panizza等也研究發現,在低有機物濃度和高電流密度條件下,有機物的電化學陽極氧化反應受傳質控制;在高有機物濃度或低電流密度條件下,有機物的電化學陽極氧化反應受電流控制(Panizza and Cerisola, 2009).
3.3 Ti/Ti4O7電極電化學降解美托洛爾的TOC去除率與毒性變化
當美托洛爾初始濃度為10 mg·L-1時,在電流密度為15 mA·cm-2、極板間距為10 mm的最適宜電化學條件下,Ti/Ti4O7陽極電化學降解美托洛爾的TOC去除率隨反應時間的變化如圖 6a所示.Ti/Ti4O7陽極電化學降解美托洛爾的TOC去除率隨反應時間而增大,在反應40 min后達到了56.5%.Romero等用紫外結合H2O2和光催化結合芬頓降解水中美托洛爾,TOC去除率在反應300 min后分別達到了30%和40%左右(Romero et al., 2015).可見Ti/Ti4O7陽極對水中美托洛爾的礦化效果較好.然而,繼續延長電化學反應的時間,TOC去除率幾乎不再發生變化.這也說明反應中美托洛爾并沒有完全轉變為二氧化碳、水等無機物,而是有一部分轉變成其他形式的含碳有機物存在.
圖 6(Fig. 6)
圖 6美托洛爾電化學降解過程中TOC去除率(a)和生物毒性(b)的變化
圖 6b顯示了在最適宜電化學條件下,Ti/Ti4O7陽極電化學降解美托洛爾時,溶液生物毒性隨反應時間的變化.美托洛爾溶液的發光細菌抑制率在前10 min逐漸升高(從63.0%增加到67.4%),之后隨著反應時間逐漸下降,在反應40 min后降為17.9%.可見,在Ti/Ti4O7陽極電化學降解美托洛爾的過程中,可能生成了一些有毒性或者毒性更強的反應產物.
3.4 Ti/Ti4O7電極電化學降解美托洛爾的降解產物鑒別
在高級氧化反應中,有機物被降解的同時,通常會伴隨著一些氧化副產物的生成,這些氧化副產物很可能會對水環境造成進一步威脅(肖宏康等, 2011; 杜青平等, 2012).通過對比LCMS檢測的Ti/Ti4O7陽極電化學降解美托洛爾過程反應0 min和30 min的質譜圖,結合美托洛爾分子自身的結構特點,包括美托洛爾在內的5種化合物被檢測出來,其二級質譜如圖 7所示.這5種化合物的質合比(m/z)分別為268、266、250、223和207.其中,化合物B(m/z=250)在美托洛爾的光催化反應中被檢測到過(Abramovic et al., 2011).在電化學氧化過程中,這些氧化中間產物可能會被繼續氧化成短鏈的小分子羧酸,最終進一步氧化為二氧化碳、水以及其他的一些無機離子.
圖 7(Fig. 7)
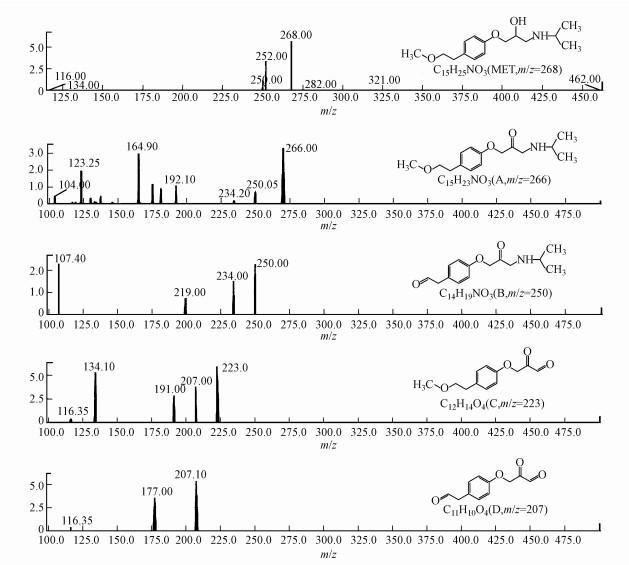
圖 7美托洛爾電化學降中間產物的二級質譜圖
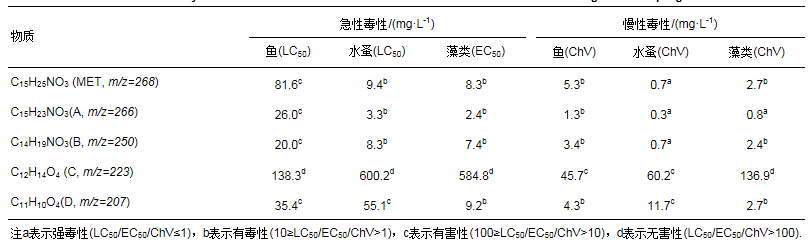
Ti/Ti4O7陽極電化學降解美托洛爾過程中,極有可能生成毒性更強的氧化中間產物.表 4顯示了用ECOSAR軟件計算出的美托洛爾及其氧化產物的生物毒性.根據《全球化學品統一分類和標簽制度》(GHS),化合物毒性分為四類:強毒性(LC50/EC50/ChV≤1)、有毒性(10≥LC50/EC50/ChV>1)、有害性(100≥LC50/EC50/ChV>10)和無害性(LC50/EC50/ChV>100).美托洛爾對水蚤類的慢性毒性呈強毒性,對水蚤類、藻類的急性毒性和藻類的慢性毒性呈有毒性;化合物A(m/z=266)對水蚤類、藻類的慢性毒性呈強毒性,對水蚤類、藻類的急性毒性和對魚類的慢性毒性呈有毒性,且其毒性值均大于美托洛爾;化合物B(m/z=250)對水蚤類的慢性毒性呈強毒性,對水蚤類、藻類的急性毒性和藻類的慢性毒性呈有毒性,且其毒性值均大于或等于美托洛爾;化合物C(m/z=223)對魚類、水蚤類和藻類的均無毒性;化合物D(m/z=207)對藻類的急性毒性和對魚類、藻類的慢性毒性呈有毒性,且其毒性值均小于或等于美托洛爾.可見,這些氧化中間產物的存在很可能是造成美托洛爾溶液的發光細菌抑制率在電化學反應前10 min升高的原因(圖 6),隨著這些氧化副產物的逐漸降解,美托洛爾溶液的發光細菌抑制率也逐漸下降.
4 結論(Conclusions)
1) 等離子噴涂法制備的Ti/Ti4O7陽極表面涂層覆蓋致密,表面Ti4O7純度高.該陽極在Na2SO4電解質溶液中的析氧電位為2.4 V.
2) Ti/Ti4O7陽極電化學降解美托洛爾反應符合一級反應動力學規律(R2>0.95).美托洛爾降解效率隨電流密度的增大而增大,隨極板間距增大而減小,隨初始濃度的增大而減小.
3) 當美托洛爾初始濃度為10 mg·L-1時,在電流密度為15 mA·cm-2、極板間距為10 mm的最適宜電化學條件下,Ti/Ti4O7陽極電化學降解美托洛爾的TOC去除率在反應40 min后可達到56.5%,溶液生物毒性在前10 min逐漸升高,之后隨著反應時間逐漸下降.
4) Ti/Ti4O7陽極電化學降解美托洛爾過程中產生了質合比為266、250、223和207的中間產物.其中,質合比為266和250的物質QSAR預測毒性值均大于或等于美托洛爾,質合比為223和207的物質QSAR預測毒性值均小于或等于美托洛爾.這些物質的產生很可能是造成美托洛爾溶液的生物毒性在電化學反應前10 min升高的原因 |
